

Natürliches Wasser liegt in der Regel nicht als chemisch reine Substanz vor. Es enthält gelöste Salze, Mineralien, organische Verbindungen sowie Gase. Diese Stoffe können je nach Wasserherkunft in unterschiedlichen Konzentrationen vorkommen. Gelöste Salze kommen als Ionen vor und können mittels Ionentausch aus dem Wasser entfernt werden.
Ionen können eine oder mehrere Ladungen tragen. Gewöhnlich tragen sie 1,2 oder 3 Ladungen (z.B. +, ++, +++) Außerdem können Ionen aus nur einem einzelnen Atom (z.B. H+) bestehen oder aus mehreren unlösbar verknüpften Atomen zu einem Molekül zusammen geführt sein (z.B. CO3--).
Die Ladung aller sich im Wasser befindlichen Ionen muss immer Null sein. D.h., die Anzahl an positiv und negativ geladenen Ionen ist gleich.
Der Ionentausch ist ein sehr leistungsfähiges Verfahren um Verunreinigungen, Rückstände und Schadstoffe aus dem Wasser zu entfernen.
Für den Ionentausch werden Stoffe eingesetzt, die aufgrund ihrer Oberflächenbeschaffenheit Ionen sehr gut anhaften lassen (= sogenannte Ionentauscher). Diese Ionentauscher werden mit positiv geladenen Wasserstoff Ionen H+ und/oder mit negativ geladenen Hydroxidionen OH- beladen.
Diese Ionen weisen eine geringe Ladung (+)(-) auf.
Je höher die Ladung und je kleiner der Radius eines Ions ist, desto stärker wird das Ion an den Ionentauscher gebunden.

Wird nun das aufzubereitende Wasser über einen Ionentauscher mit positiv und negativ geladenen Ionen geleitet, werden alle positiv geladene Kationen (+) im Wasser gegen positiv geladene Wasserstoff Ionen (H+) und alle negativ geladene Anionen (-) im Wasser gegen negativ geladene OH Ionen (OH-) getauscht.
D. h., der Ionentauscher stößt alle Wasserstoff Ionen und Hydroxid Ionen ab und nimmt die positiv und negativ geladenen Ionen aus dem Wasser auf. Die vom Ionentauscher abgestoßenen H+ und OH- Ionen verbinden sich nun außerhalb des Ionentauschers zu reinstem, rückstandslosem Wasser H2O.
Dieser Prozess läuft solange ab, bis der Ionentauscher keine H+ oder OH- Ionen mehr abzugeben hat.
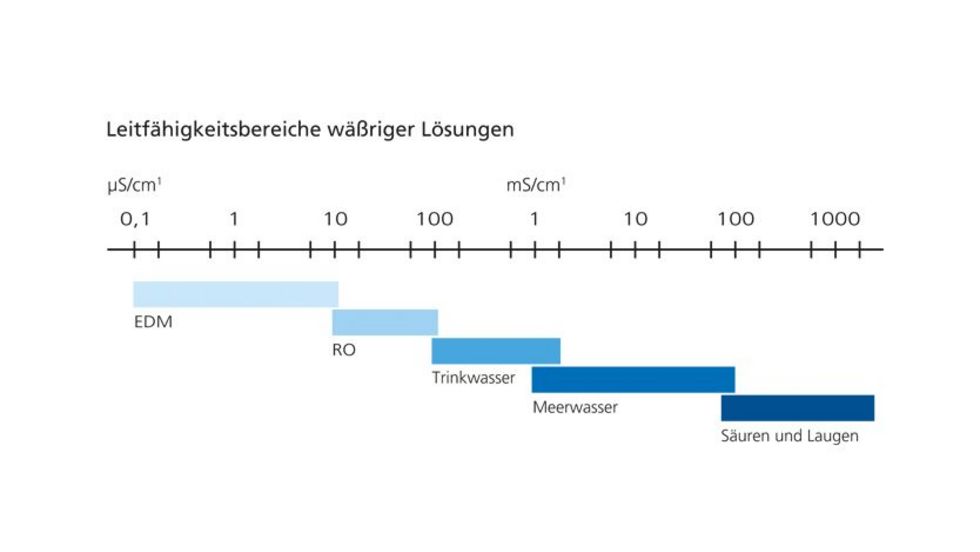
Deionisiertes Wasser wird auch VE Wasser (= vollentsalztes Wasser) genannt. Die Reinheit des VE Wassers wird über seine Leitfähigkeit ausgedrückt.
In Lösungen wird der Strom durch Kationen und Anionen getragen = Elektrische Leitfähigkeit. Kationen und Anionen sind sozusagen die beweglichen Ladungsträger. Diese Leitfähigkeit wird als Leitwert in µs/cm angegeben.
Je reiner das Wasser, desto niedriger ist der Leitwert. Reinstwasser hat z.B. einen sehr niedrigen Leitwert von < 0,1 µs/cm.
Bild: Leitfähigkeitsbereiche wässriger Lösungen
Meist wird die Teilentsalzung zur Entfernung der Hydrogencarbonatsalze eingesetzt. Es werden also nur die positiv geladenen Kationen Ca++ und Mg++ aus den Karbonat Härtebildnern Kalziumcarbonat und Magnesiumcarbonat gegen Wasserstoff Ionen H+ getauscht.
Aus der Karbonathärte CaCO3 entsteht dadurch z.B. Kohlensäure.
(H+) + (HCO3) = H2CO3
Im Gegensatz zum Vollentsalzten Wasser (= VE Wasser) bleiben alle anderen Salze im Wasser enthalten. Eine Teilentsalzung ist somit nur sinnvoll, wenn eine z.B. reine Enthärtung des Wassers (wie im oben beschriebenen Verfahren) für die Anwendung ausreichend ist.
Es können durch eine selektive Beladung der Ionentauscher aber auch mittels Adsorbtion nur bestimmte Schwermetalle (z.B. Blei, Cadmium oder Quecksilber) aber auch Anionen wie Nitrat und Sulfat entfernt werden.
Die Wahl des Entsalzungsverfahrens sowie der Entsalzungsgrad ergeben sich sowohl aus der gewünschten Reinheit des Wassers als auch aus dem angewandten Verfahren und den betrieblichen und ökonomischen Bedingungen.

Bei der Vollentsalzung werden alle gelösten Salze aus dem Wasser entfernt.
Der Ionentauscher wird sowohl mit positiv geladenen H+ Ionen als auch mit negativ geladenen OH- Ionen beladen. Wird nun das aufzubereitende Wasser über den Ionentauscher geleitet, werden alle positiv und negativ geladenen Ionen getauscht.
Wie bereits unter dem Punkt „Das Prinzip des Ionentausches“ beschrieben entsteht nun durch die Abgabe von H+ und OH-, reinstes Wasser.
(H+) + (OH-, ) = H2O
Im Gegensatz zu destilliertem Wasser ist VE Wasser nicht sauer und bietet auch gegenüber Osmosewasser, durch die Entfernung von Kohlensäure, entscheidende Vorteile.
• Schutz vor Korrosion und unlöslichen Ablagerungen durch die Entfernung von Chloriden, Sulfaten und Nitraten aus dem Wasser.
• Abhängig von der Qualität des Eingangswassers sinkt die elektrische Leitfähigkeit auf bis zu < 0,1 µs/cm (TREF25).
• Der pH-Wert liegt im neutralen Bereich, da Kohlensäure und Kieselsäure entfernt werden.
• Der niedrige Leitwert und neutrale pH-Wert bleiben konstant und garantieren damit lange Standzeiten Ihrer Maschinen.
• Gelöste anorganische Ionen werden problemlos entfernt. Der Widerstand nach Aufbereitung liegt bei > 18,2 MΩ (bei 25°C) und einem TOC Wert von <1 ppb.
