

L’eau naturelle n’existe pas en règle générale comme substance chimiquement pure. Elle contient des sels dissouts, des sels minéraux, des composés organiques ainsi que des gaz. Ces substances peuvent
être présentes dans différentes concentrations selon l’origine de l’eau. Les sels dissouts sont présents sous forme d’ions et peuvent
être éliminés de l’eau au moyen de l’échange d’ions ou de l’absorption (= liaison à un corps solide).
Les ions peuvent porter une ou plusieurs charges. Ils portent habituellement 1,2 ou 3 charges
(par ex. +, ++, +++). En outre, les ions peuvent se composer d’un atome individuel (par ex. H+) ou de
plusieurs atomes attachés ensemble pour former une molécule (par ex. CO3--).
La charge de tous les ions présents dans l’eau doit toujours être nulle. Cela signifie que le nombre d’ions positivement et négativement chargé est le même.
L’échange d’ions est un procédé très performant pour éliminer de l’eau les impuretés, les résidus et le
polluants.
Pour l’échange d’ions, des substances sont utilisées qui font que les ions adhèrent très bien en raison de l’état de leur surface (= lesdits échangeurs d‘ions). Ces échangeurs d’ions sont chargés d‘ions
hydrogène positivement chargés H+ et/ou d’ions hydroxydes négativement chargés provenant de OH.
Ces ions affichent une moindre charge (+)(-).
Plus la charge est élevée et plus le rayon du ion est petit, plus l’ion est fortement lié à l’échangeur d’ions.

Si l’eau à traiter est désormais conduite via un échangeur d’ions avec des ions positivement et négativement
chargés, tous les cations positivement chargés (+) dans l’eau sont changés contre les ions hydrogène positivement chargés dans l‘eau (H+), et tous les nions négativement chargés (-) dans l’eau sont échangés contre les ions négatifs OH (OH-). Cela signifie que l’échangeur d’ions repousse tous les ions hydrogène et les ions hydroxydes et absorbe de l’eau les ions positivement et négativement chargés. Les ions H+ et OH- repoussés par l’échangeur d’ions se lient désormais à l’extérieur de l’échangeur d’ions pour former de l’eau H20 extra-pure et sans résidus.
Ce processus se déroule jusqu’à ce que l’échangeur d’ions ne relâche plus d‘ions H+ ou OH-.
L’eau dé-ionisée est nommée aussi eau CD (= eau complètement déminéralisée).
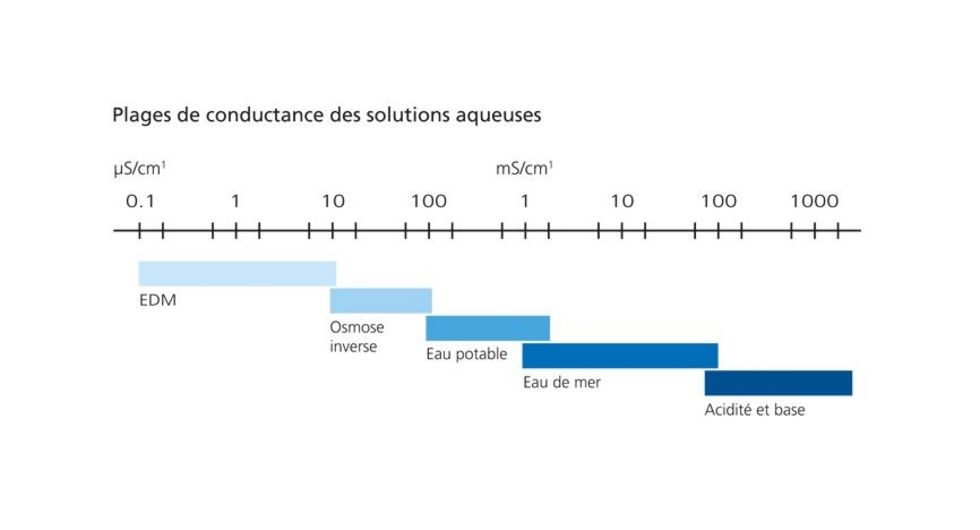
La pureté de l’eau CD est exprimée par sa conductivité.
Le flux est porté par les cations et les anions = conductance électrique. Les cations et les anions sont pour ainsi dire les porteurs de charge mobiles.
Cette conductance est indiquée comme valeur de conductivité en µs/cm1.
Plus l’eau est pure, plus la valeur de conductivité est basse. L’eau extra-pure a par ex. une valeur très basse de < 0,1 µs/cm.
Concernant la déminéralisation partielle (= échange d’ions sélectif), l’échangeur d’ions n’est seulement chargé que d’ions H+ ou d’ions OH-. Cela signifie que l’échangeur d’ions ne peut échanger que les ions positivement ou négativement chargés.
La plupart du temps, la déminéralisation est utilisée pour l’élimination des sels du type bicarbonate. Donc, seulement les cations positivement chargés Ca++ et Mg++ des agents de dureté du carbonate, le carbonate de calcium et le carbonate de magnésium peuvent être échangés contre les ions hydrogène H+.
Le gaz carbonique se forme par ex. à partir de la dureté du carbonate CaCO3.
(H+) + (HCO3) = H2CO3
Contrairement à l’eau complétement déminéralisée (= eau CD), tous les autres sels restent contenus dans l’eau. La déminéralisation partielle n’est sensée que si par ex. l’adoucissement pur de l’eau (comme dans le procédé décrit ci-dessus) est suffisant pour l’application.
Par la charge sélective des échangeurs d’ions, mais également au moyen de l’absorption, seulement certains métaux lourds (par ex. le plomb, le cadmium ou le mercure), mais aussi les anions tels que le nitrate et le sulfate peuvent être éliminés.
Le choix du procédé de déminéralisation ainsi que du degré de déminéralisation résulte de la pureté souhaitée de l’eau ainsi que du procédé appliqué et des conditions d’exploitation et économiques.

Concernant la déminéralisation complète, tous les sels dissouts sont éliminés de l’eau.
L’échangeur d’ions est chargé d’ions positivement chargés H+ et d’ions négativement chargés OH-. Si l’eau à traiter est désormais conduite via l’échangeur d’ions, tous les ions positivement et négativement chargés sont échangés ou absorbés (= liés au corps solide).
Comme déjà décrit sous le point « Le principe de l’échange d’ions », l’eau extra-pure est désormais produite par le relâchement d’eau extra-pure H+ et OH-.
(H+) + (OH-) = H2O
Contrairement à l’eau distillée, l’eau CD n’est pas acide et offre aussi des avantages décisifs par rapport à l’eau osmosée grâce à l’élimination du gaz carbonique.
• Protection contre la corrosion et les dépôts grâce à l’élimination du chlorure, du sulfate et du nitrate de l’eau.
• Selon la qualité de l’eau d’entrée, la conductance électrique baisse jusqu’à < 0,1 µs/cm1 (TREF25).
• La valeur pH est dans une plage neutre, étant donné que le gaz carbonique et l’acide silicique ont été éliminés.
• La basse valeur de conductivité et la valeur pH neutre restent constantes et garantissent ainsi les longues durées de vie de vos machines.
• Les ions inorganiques dissouts sont éliminés sans problèmes.
La résistance après le traitement est de 18,2 MΩ (à 25°C) et avec une valeur TOC de <1 ppb.
