

L’acqua naturale non è di norma una sostanza chimicamente pura: contiene sali disciolti, minerali, composti organici e gas. Queste sostanze possono essere presenti in varie concentrazioni a seconda dell’origine dell’acqua. I sali disciolti si presentano sotto forma di ioni e possono essere rimossi dall’acqua tramite scambio ionico o adsorbimento (= legame con un corpo solido).
Gli ioni possono assumere una o più cariche: normalmente ne possiedono una, due o tre (+, ++, +++). Possono inoltre essere costituiti da un solo atomo (p. es. H+) oppure da più atomi legati indissolubilmente tra loro a formare una molecola (p. es. CO3--).
La carica di tutti gli ioni presenti nell’acqua deve essere sempre zero: ciò significa che il numero di ioni caricati positivamente e negativamente è uguale.
Lo scambio ionico è un processo molto efficace per eliminare dall’acqua impurità, residui e sostanze nocive.
Si utilizzano a tale scopo sostanze che in virtù della propria conformazione superficiale favoriscono notevolmente l’adesione degli ioni (= scambiatori ionici). Gli scambiatori ionici si caricano di ioni idrogeni H+ caricati positivamente e/o ioni idrossidi OH- caricati negativamente.
Questi ioni presentano una carica ridotta (+)(-).
Più elevata è la carica e più piccolo è il raggio di uno ione, tanto più fortemente esso si lega allo scambiatore ionico.

Se l’acqua da trattare viene condotta attraverso uno scambiatore ionico con ioni caricati positivamente e negativamente, tutti i cationi a carica positiva (+) presenti nell’acqua vengono sostituiti da ioni idrogeni a carica positiva (H+) e tutti gli anioni a carica negativa (-) presenti nell’acqua vengono sostituiti da ioni idrossidi a carica negativa (OH-). Questo perché lo scambiatore ionico respinge tutti gli ioni idrogeni e gli ioni idrossidi e assorbe dall’acqua gli ioni caricati positivamente e negativamente. Gli ioni H+ e OH- respinti dallo scambiatore ionico si legano al di fuori di esso formando acqua H2O purissima e senza residui.
Questo processo continua finché lo scambiatore ionico non ha più ioni H+ o OH- da rilasciare.
L’acqua deionizzata è definita anche acqua completamente dissalata.
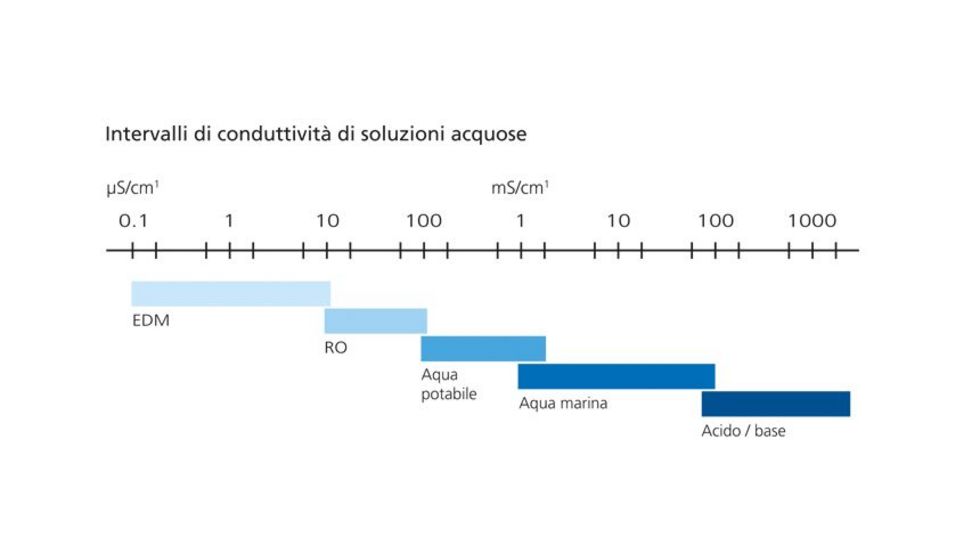
La purezza dell’acqua completamente dissalata si esprime in termini di conduttività.
Nelle soluzioni. l’elettricità è condotta dai cationi e dagli anioni = conduttività elettrica. Cationi e anioni sono quindi per così dire i portatori mobili di carica.
Tale proprietà è indicata dal valore di conduttanza in µs/cm1.
Più pura è l’acqua, più basso sarà il valore di conduttanza: l’acqua ultrapura, per esempio, ha un bassissimo valore di conduttanza di <0,1 µs/cm.
Nella dissalazione parziale (= scambio ionico selettivo), lo scambiatore ionico si carica soltanto di ioni H+ o ioni OH-. In altre parole, lo scambiatore ionico può scambiare soltanto ioni caricati positivamente o negativamente.
La dissalazione parziale è utilizzata prevalentemente per la rimozione di sali idrogenocarbonati: soltanto i cationi caricati positivamente Ca++ e Mg++ degli agenti indurenti del carbonato, ossia carbonato di calcio e carbonato di magnesio, vengono sostituiti con ioni idrogeni H+.
Dall’agente indurente carbonato CaCO3 deriva in tal modo p.es. anidride carbonica.
(H+) + (HCO3) = H2CO3
Diversamente da quanto accade nella dissalazione completa, tutti gli altri sali restano nell’acqua. La dissalazione parziale è quindi indicata se p. es. è sufficiente il semplice addolcimento dell’acqua, come nel processo descritto sopra.
Per mezzo della carica selettiva degli scambiatori ionici, oppure tramite adsorbimento, è possibile rimuovere soltanto determinati metalli pesanti (piombo, cadmio, mercurio) e anche anioni come nitrati e solfati.
La scelta del processo e del grado di dissalazione dipendono dalla purezza dell’acqua che si intende ottenere, dal metodo impiegato e da considerazioni di natura aziendale ed economica.

Nella dissalazione completa vengono rimossi dall’acqua tutti i sali disciolti.
Lo scambiatore ionico è caricato sia di ioni H+ caricati positivamente, sia di ioni OH- caricati negativamente. Quando l’acqua da trattare viene condotta attraverso lo scambiatore ionico, tutti gli ioni caricati positivamente e negativamente vengono sostituiti o adsorbiti (= legati a corpi solidi).
Come già descritto alla voce “Il principio dello scambio ionico”, da questo processo di rilascio di H+ e OH- si genera acqua purissima.
(H+) + (OH-, ) = H2O
Contrariamente all’acqua distillata, l’acqua completamente dissalata non è acida e offre notevoli vantaggi anche rispetto all’acqua osmotizzata grazie all’eliminazione dell’anidride carbonica.
• Protezione dalla corrosione e dai depositi insolubili grazie all’eliminazione di cloruro, solfati e nitrati dall’acqua.
• A seconda della qualità dell’acqua in entrata, la conduttanza elettrica scende fino a < 0,1 µs/cm1 (TREF25).
• Il valore di pH è neutro poiché vengono eliminati l’anidride carbonica e l’acido silicico.
• Il basso valore di conduttanza e il pH neutro restano costanti garantendo la lunga durata delle vostre apparecchiature.
• Gli ioni inorganici disciolti vengono eliminati senza problemi. La resistenza dopo il trattamento è 18,2 MΩ (a 25°C) e il valore TOC è <1 ppb.
